Metodika OSG
Metoda výpočtu kombinovaného rizika trisomie chromozomu č.21 (Downova syndromu - T21), Edwardsova syndromu (trisomie 18 – T18) a Patauova syndromu (trisomie 13 –T13) v I. trimestru a hodnocení ultrazvukových minor markerů. [7,12,21,31,33]
Pro výpočet rizika T21 a kombinovaného rizika T13/18 se užívá metoda věrohodnostních koeficientů (Likelihood Ratio – LR). Riziko T21 dle věku matky je násobeno kombinovaným LR, který je vypočítán z hodnot měřených markerů. LR individuálního markeru je numericky roven poměru výšky lognormální distribuční křivky daného markeru u postižených ku výšce lognormální distribuční křivky nepostižených nad naměřenou hodnotou markeru. Logaritmicky transformované hodnoty markeru jsou uváděny v násobcích mediánu (MoM). Kombinovaný LR z hodnot více markerů je součinem individuálních LR, který je modifikován korelačními koeficienty mezi markery.
Pro výpočet rizika T21 a kombinovaného rizika T13/18 se jako screeningových markerů používají hodnoty ultrazvukové nuchální translucence plodu (NT) a plazmatického těhotenského proteinu A (PAPP-A) a volné beta podjednotky lidského choriového gonadotropinu (FβhCG) v séru matky.
LR kategorických markerů (tzn. přítomen / nepřítomen) – například minor markerů aneuploidie ve II. trimestru - je vypočítán poměrem detekce ( = část postižených s přítomným markerem - DR ) ku falešné pozitivitě ( = část nepostižených s přítomným markerem - FPR). Korelace mezi jednotlivými minor markery aneuploidií dosud nebyly studovány a proto je použita metoda výpočtu kombinovaného LR dle Nicolaidese [33], která předpokládá nulovou korelaci mezi minor markery a používá i hodnot „Negativního LR“ vypočítaného poměrem falešné negativity ( = část postižených bez markeru - FNR ) ku specificitě ( = část nepostižených bez markeru – SR). Kombinovaný LR je součinem LR a Negativních LR podle přítomnosti nebo absence jednotlivých minor markerů.
Absence nosní kosti plodu (NB) je natolik významným a řídkým nálezem (očekávaná DR = 70% a FPR = 1% u neselektované kavkazské populace), že není zařazena do minor markerů a je hodnocena jako zvláštní nález.
Specifické riziko T21 [7,12,26,32]
Pro výpočet specifického (věkového) rizika Downova syndromu v termínu je použita regresní rovnice:
Risk= 0.999373-e ( (0.286*věk )-16.2395)/0.000627 + e ((0.286*věk)-16.2395) [7].
Nastavené je riziko v termínu, protože jeho hodnoty byly odvozeny od klinických pozorování (porodní prevalence T21 dle věku).
Specifická rizika zjištěná v české populaci nebyla nastavena kvůli dosažení kompatibility s jinými screeningovými programy [26] . Dalším důvodem byl fakt, že po regresi nejsou rozdíly specifických rizik u těhotných nad 25 let věku významné (viz. tabulka 1) .
Tabulka 1: Srovnání specifických rizik Downova syndromu české a anglické populace.
|
Věk v termínu |
Šípek et al. [26] |
Cuckle et al. [7] |
|
18 |
3069 |
1600 |
|
19 |
2290 |
1500 |
|
20 |
2163 |
1500 |
|
21 |
2074 |
1500 |
|
22 |
1780 |
1500 |
|
23 |
1906 |
1500 |
|
24 |
1697 |
1400 |
|
25 |
1777 |
1400 |
|
26 |
1584 |
1300 |
|
27 |
1369 |
1200 |
|
28 |
1264 |
1100 |
|
29 |
1221 |
1000 |
|
30 |
1228 |
910 |
|
31 |
1404 |
800 |
|
32 |
970 |
680 |
|
33 |
897 |
580 |
|
34 |
588 |
470 |
|
35 |
471 |
380 |
|
36 |
363 |
310 |
|
37 |
244 |
240 |
|
38 |
210 |
190 |
|
39 |
158 |
150 |
|
40 |
95 |
110 |
|
41 |
79 |
85 |
|
42 |
78 |
65 |
|
43 |
38 |
50 |
|
44 |
43 |
40 |
|
45 |
25 |
30 |
Asi 26 % plodů s T21 je potraceno mezi 11-14 týdnem a termínem (období CVS) a 23% postižených plodů je potraceno mezi 16. týdnem a termínem (období AMC). Regredovaná prevalence T21 vztažená k prevalenci porodní = 1 se počítá dle vzorce:
10 exp( 0.2718*log10 (gestace)2 - 1.023 * log10 (gestace) +0.9425) [32].
Rekurence rizika T21
Při předcházejícím těhotenství s plodem postiženým trisomií 21 se specifické riziko dle věku v termínu zvyšuje o 0,35%. Program OSG neprovádí automatickou změnu apriorního rizika při pozitivní anamnese, protože tato těhotenství jsou apriori screening pozitivní. Ve zprávě se objevuje poznámka : CAVE trisomie chrozomu 21 v anamnese. Eventuální přepočet rizika doporučujeme provádět až v rámci specializované genetické konzultace.
Tabulka 2: Příklady modifikace specifického rizika předcházejícím těhotenstvím s trisomickým plodem
|
Věk v termínu |
Specifické riziko T21 |
Modifikované riziko T21 |
|
20 |
1/1500 |
1/250 |
|
25 |
1/1400 |
1/240 |
|
30 |
1/910 |
1/220 |
|
35 |
1/380 |
1/170 |
|
40 |
1/110 |
1/80 |
Specifické riziko Edwardsova syndromu (T18 ) a Patauova syndromu (T13) [30]
Mezi 12. týdnem a termínem se spontánně potratí 80-85 % těhotenství s plody postiženými těmito trisomiemi. Protože hodnoty markerů kombinovaného testu u těchto aneuploidií jsou podobné, OSG používá algoritmu výpočtu rizika pro obě tyto letální entity zároveň : Riziko T13 nebo T18. [31]
Tabulka 3 : Srovnání rizik T13/18 dle věku matky a gestačního stáří.
|
Věk v termínu |
Trisomie 13 (1/n) |
Trisomie 18 (1/n) |
Trisomie 13/18 (1/n) |
|||
|
12. týden |
Termín |
12. týden |
Termín |
12. týden |
Termín |
|
|
20 |
7600 |
42500 |
2500 |
18000 |
1880 |
12650 |
|
25 |
6800 |
37500 |
2200 |
16000 |
1660 |
11220 |
|
30 |
4500 |
24900 |
1450 |
10500 |
1100 |
7400 |
|
35 |
1900 |
9900 |
600 |
4200 |
460 |
2950 |
|
40 |
550 |
2690 |
170 |
1140 |
130 |
800 |
|
42 |
300 |
1500 |
90 |
650 |
70 |
450 |
Screening u dvojčat [20, 28]
Incidence dvojčat stoupá se zvyšujícím se věkem matky a s rozšiřováním metod asistované reprodukce. Je též závislá na rase (nízká incidence u Asijců, vysoká u Afričanů). Recentní odhad průměrné incidence dvoučetných gravidit je 2/100 v 10-14. týdnu a 1,4/100 při porodu.
80% dvojčat je bichoriálních a 20% monochoriálních. Ultrazvukovým obrazem bichorionicity je “Lambda resp. delta znak” což je trojúhelníková extense placentární density mezi oběma vaky blan. Dělící membrána mezi plody je složena ze čtyř vrstev. Ultrazvukovým obrazem monochorionicity je „T- znak„ - obraz dvojvrstevné membrány odstupující v pravém úhlu ze společného choria.
Všechna monochoriální dvojčata jsou monozygotní (MZ). Většina bichoriálních dvojčat dizygotních (DZ), ale též malá část bichoriálních dvojčat (asi 10%) může být MZ. Lambda znak (bichorionicita) tedy neznamená průkaz DZ dvojčat.
Lambda (delta) znak:
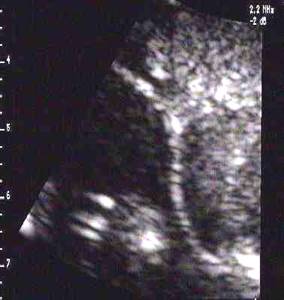
Metoda určování rizika aneuploidií u mnohočetných gravidit je méně přesná. Již stanovení základního (specifického) rizika dle věku matky se liší dle zygozity. U DZ dvojčat je riziko, že alespoň jeden plod je postižen, rovno dvojnásobnému riziku věku. U MZ dvojčat je riziko stejné, jako u jednočetných těhotenství (ale jsou postiženy oba identické plody). Při neznámé zygozitě (2/3 pravděpodobnost, že se jedná o DZ dvojčata) je riziko postižení alespoň jednoho plodu rovno 1.66 * riziko věku.
Při hodnocení biochemických markerů u dvojčat se používá průměrného zvýšení u dvojčat, které ovšem nemůže reflektovat variabilní vztahy a funkce obou placent.
PAPP-A u dvojčat je v I. trimestru průměrně zvýšen na 1.86 MoM.
FbhCG u dvojčat je v I. trimestru průměrně zvýšen na 2.1 MoM.
Při potvrzení počtu plodů = 2 se vyvolá tabulka s kalkulátorem průměru CRL ( BPD), který se používá pro určení gestačního stáří, maximální naměřené hodnoty NT a naopak minimální naměřené hodnoty délky nosní kosti (NB). Vypočítané kombinované riziko aneuploidií pak platí pro dvojče s vyšším rizikem. Hodnota délky nosní kosti je posuzována zvlášť: její nepřítomnost nebo významná hypoplasie (pod 1,5 mm) je brána jako patologický příznak bez vztahu k hodnotám ostatních markerů.
Odhad gestačního stáří (GS) z ultrazvukového měření vzdálenosti Temeno-kostrč (CRL) [27]
Pro odhad gestačního stáří (GS) je použita regrese dle Robinsona: GS (dny) = A + B*X + C*X*X + D*X*X*X
X = CRL (mm)
Tabulka 4: Gestační stáří (GS) dle CRL.
|
CRL |
GS |
|
20 |
59 |
|
30 |
68 |
|
40 |
76 |
|
50 |
83 |
|
60 |
89 |
|
70 |
93 |
|
80 |
97 |
|
90 |
100 |
|
100 |
101 |
Referenční gestační stáří
Při prvním ultrazvukovém vyšetření je provedeno srovnání menstruačního a ultrazvukového gestačního stáří (GA). Po zhodnocení ultrazvukového měření v dané graviditě je stanoveno Referenční gestační stáří, se kterým se srovnávají výsledky všech následujících ultrazvukových měření a které slouží k určení všech termínů následných vyšetření. Referenční gestační stáří se určuje:
- Podle posledního měření CRL mezi 11-14 týdnem [27];
- podle prvního měření BPD, pokud bylo první ultrazvukové vyšetření provedeno ve II. trimestru. Pro přesné hodnocení gestačního stáří v individuálních případech ve II. trimestru doporučujeme použít hodnoty HC případně AC.
Podle referenčního gestačního stáří se počítá :
- Optimum pro odběr biochemických markerů v I. trimestru (mezi 10+3 a 12+3);
- optimum pro měření NT a NB (mezi 11+3 a 13+0 );
- optimum pro odběr biochemických markerů ve II. trimestru (mezi 15+3 a 17+3);
- datum odpovídající počátku 20. týdne a termín porodu;
- diskrepance mezi menstruačním a referenčním stářím;
- Z-score (ultrazvukový rozměr naměřený - očekávaný dle referenčního gestačního stáří / specifická standardní odchylka pro referenční gestační stáří).
Ultrazvukové nuchální projasnění plodu (NT) v 11-13. týdnu [ 16,19]
Medián NT normálně stoupá s CRL. Čím je NT vyšší (vyjádřeno v násobcích mediánu - MoM pro dané gestační stáří), tím je i vyšší pravděpodobnost, že plod je postižen T21 nebo další vadou. Tato pravděpodobnost je vyjádřena věrohodnostním koeficientem (LR).
Naopak, čím je hodnota NT nižší, tím je i nižší pravděpodobnost postižení. Zvýšení NT v 11-13. týdnu je nespecifický znak ohrožení plodu. Může znamenat i jiné chromosomální aberace, vrozené vady nebo hrozící potrat. Riziko dalších abnormalit plodu roste se zvyšováním hodnot NT. U hodnot NT nad 5 mm je to téměř v 50 % případů. Hodnoty NT nad 1,7 MoM jsou také indikací k fetálnímu echokariografickému vyšetření.
V pracích londýnské Nadace Fetální Mediciny se k výpočtu rizika aneuploidií používá parametr „delta NT“ což je rozdíl hodnoty naměřené NT od očekávaného mediánu NT dle CRL. Delta NT se uvádí v milimetrech. Dokud nebude shromážděno dostatečné množství důkazů o výhodnosti tohoto způsobu vyjádření hodnoty NT pro výpočet rizika, budeme používat klasickou metodiku násobku mediánů (MoM)
Tabulka: 5 Regredované hodnoty mediánů NT [19].
|
CRL (mm) |
NT (mm) |
|
49 |
1,4 |
|
59 |
1,55 |
|
69 |
1,7 |
|
79 |
1,8 |
Zásady měření NT dle Nicolaidese
- NT lze v 95 % případů měřit transabdominální UZ sondou. U zbytku těhotných je nutno použít sondu transvaginální. Výsledky měření oběma způsoby jsou hodnoceny stejně..
- UZ přístroj musí mít odpovídající kvalitu. Je opatřen záznamovým zařízením a jednotka posunu kaliperů je 0,1 mm.
- Průměrný čas měření NT je 10 min.
- Sonografista musí zobrazit mediosagitální řez fetální páteří a změřit CRL.
- Minimální hodnota CRL při měření NT je 45 mm, maximální hodnota je 84 mm. (tzn. mezi 11+3 a 13+6 týdnem) . Úspěch měření lze očekávat v 98-100 % případů.
- Měření NT se provádí v optimálním sagitálním řezu.
- Zvětšený obraz plodu při měření zaujímá alespoň 3/4 obrazovky. Zvětšení musí být takové, aby minimální posun kaliperem znamenal vzdálenost 0,1 mm.
- Je nutno odlišit obraz fetální kůže a amnia. Při nejasnosti obou struktur je nutno čekat na spontánní pohyb plodu nebo poklepat na stěnu břišní či vyzvat těhotnou k zakašlání.
- Měří se maximální hodnota NT mezi kůží plodu a fascií kryjící krční páteř plodu. Měří se několikrát a je uvedena maximální hodnota NT. Kalipery se umísťují na UZ linie ("on-on") (viz obrázek).

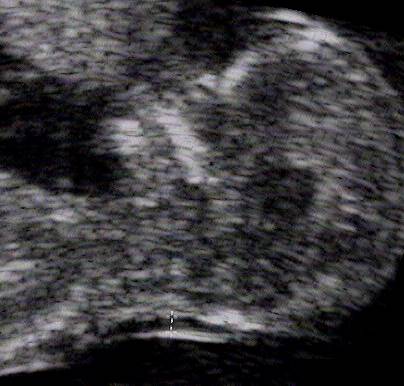
- NT se měří při neutrální poloze plodu. Flexe či extense plodu může znamenat zkreslení hodnoty NT o ± 0,5 mm.
- U 5 - 10 % měření interferuje s měřením NT pupečník. V tomto případě se doporučuje hodnotit nejmenší hodnoty NT.
- Kvalita měření se hodnotí epidemiologicky (parametry distribuce NT) a z předložených obrazových záznamů. Pro získání erudice je nutno provést asi 100 vyšetření.
- NT neměříme v harmonickém zobrazení
Statistické parametry NT pro výpočet rizika T21 [6,9,16,19]
Tabulka 5: Statistické parametry NT u T21
|
|
Nepostižení |
Postižení |
||
|
Marker |
Mean Log10 |
SD Log10 |
Mean Log10 |
SD Log10 |
|
NT |
0.000 |
0.120 |
0.305 |
0.235 |
Hranice Gaussovské distribuce NT : 0.8 – 5 MoM. Znamená to např. že hodnoty NT nižší než 0.8 MoM dále riziko Trisomie 21 nesnižují. Korelace mezi NT a jinými screeningovými markery I. trimestru není významná. Novějších práce doporučují omezit hranice Gaussovské distribuce NT mezi 0.8 – 2.5 MoM. Též je zjišťována změna distribučních parametrů NT s postupujícím těhotenstvím: Ve 13. týdnu se průměrný rozdíl v NT mezi postiženými a zdravými plody snižuje. To je důvodem pro snížení optimálního gestačního stáří pro měření NT na 12. týden.
Statistické parametry PAPP-A a Fb hCG pro výpočet rizika T21. [23]
Tabulka 6: Statistické parametry PAPP-A a FbhCG u T21
|
|
Nepostižení |
Postižení |
||
|
Marker |
Mean Log10 |
SD Log |
Mean Log10 |
SD Log |
|
PAPP-A |
0 |
0.2659 |
- 0.3704 |
0.3471 |
|
Fb hCG |
0 |
0.2833 |
0.2540 |
0.2870 |
Novější údaje potvrzují optimální gestační stáří pro vyšetření PAPP-A na 10. týden. V pozdějších stadiích těhotenství efektivita PAPP-A klesá a distribuční parametry u postižených a nepostižených gravidit se sbližují.
U vyšetření Fb hCG byla zjištěna tendence opačná - efektivita tohoto markeru stoupá s gestačním stářím a je optimální až ve 13. týdnu.
Tabulka 7: Korelační koeficienty PAPP-A / Fb hCG (Log10) u T21
|
Nepostižení |
Postižení |
|
0.1407 |
0.0648 |
Statistické parametry NT pro výpočet rizika trisomie 13/18 (T13/18) [31]
Tabulka 8: Statistické parametry NT u trisomie 13/18
|
|
Nepostižení |
Postižení |
||
|
Marker |
Mean Log10 |
SD Log10 |
Mean Log10 |
SD Log10 |
|
NT |
0.000 |
0.120 |
0.4500 |
0.2521 |
Statistické parametry PAPP-A a FbhCG pro výpočet rizika T 13/18 [31]
Tabulka 9: Statistické parametry PAPP-A a FbhCG u T13/18
|
|
Nepostižení |
Postižení |
||
|
Marker |
Mean Log10 |
SD Log |
Mean Log10 |
SD Log |
|
PAPP-A |
-0.004 |
0.2431 |
- 0.6976 |
0.3000 |
|
Fb hCG |
0.004 |
0.2558 |
-0.4262 |
0.3165 |
Tabulka 10: Korelační koeficienty NT / Fb hCG (Log10) použité u T13/18 .
|
Nepostižení |
Postižení |
|
-0.057 |
0.152 |
Tabulka 11: Korelační koeficienty PAPP-A / Fb hCG (Log10) použité u T13/18.
|
Nepostižení |
Postižení |
|
0.160 |
0.105 |
Absence nosní kosti [36,37,38,39,40]
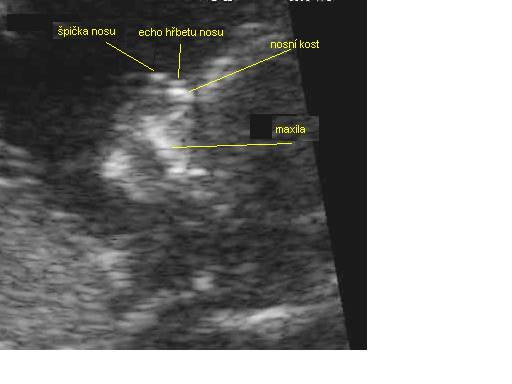
Nosní kost (NB) je možno vyšetřit v 11-14. týdnu jako typickou strukturu složenou ze tří linií : dvě basální rovnoběžné linie tvoří odraz kůže a nosní kosti a menší uložena ventrálněji tvoří odraz špičky nosu. NB v 11-14. týdnu není přítomna nebo je hypoplastická asi u 70% plodů s trisomií 21, u 30% plodů s jinými aneuploidiemi, ale jen asi u 1% nepostižených plodů . Význam nálezu absence/hypoplasie NB stoupá od 11. do 13. týdne.
Absenci nebo hypoplasii (pod 2,5 mm) NB lze pozorovat u plodů s aneuploidií také ve II. trimestru. Absence/hypoplasie NB je častěji pozorována u nepostižených plodů afro-karibského (8%) nebo asijského (5 %) etnika. Nález absence/hypoplasie NB je vždy indikací ke genetické konzultaci protože zvyšuje riziko postižení plodu aneuploidií nejméně 30x.
Obraz normální nosní kosti
Tabulka 12: Hodnoty 50 a 2,5 percentilu délky nosní kosti v závislosti na gestačním stáří. [39]
|
Gestační stáří (týden) |
2.5 percentil (mm) |
50 percentil (mm) |
|
11 |
1,3 |
2,3 |
|
12 |
1,7 |
2,8 |
|
13 |
2,2 |
3,1 |
|
14 |
2,2 |
3,8 |
|
15 |
2,8 |
4,3 |
|
16 |
3,2 |
4,7 |
|
17 |
3,7 |
5,3 |
|
18 |
4,0 |
5,7 |
|
19 |
4,6 |
6,3 |
|
20 |
5,0 |
6,7 |
Zkrácení maxilly [42]
U plodů s trisomií 21 bylo pozorováno zkrácení horní čelisti, které bylo výraznější v případě současného nálezu absence NB.
Pulzace ductus venosus
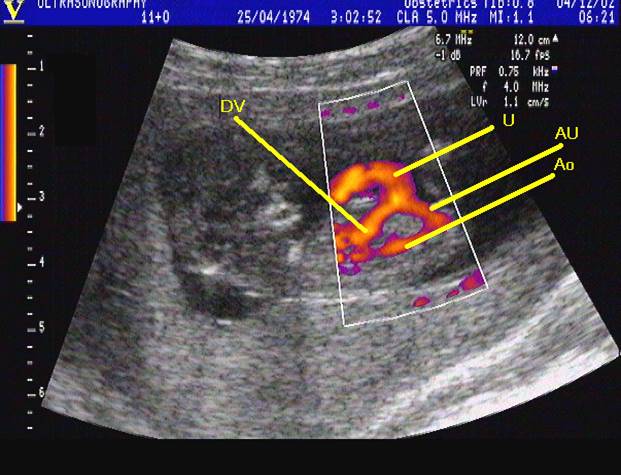
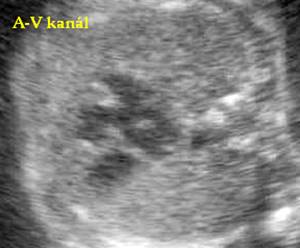
Abnormální pulzace ductus venosus při dopplerometrii je spojena s vrozenými vadami kardiovaskulárního ústrojí, chromozomálními aberacemi a nespecifickým ohrožením gravidity. Posuzuje se rychlost průtoku duktem při systole síní (vrchol A), systole komor ( vrchol S), diastole (vrchol D) a pulsatilní index (PIv ) vypočítaný z hodnot (S-A/ maximální rychlost průtoku). Abnormální pulzace duktu - snížení vrcholu A a zvýšení PIv je přítomna u 70% plodů s trisomií 21.[41] (viz. následující obrázek)
Důležité faktory ovlivňující výsledky screeningu v I. trimestru [10]
- Hmotnost těhotné při odběru krve
Tabulka13: Zjištěné median MoM biochemických markerů u hmotnostních skupin těhotných.
|
Hmotnostní skupina (kg) |
PAPP-A |
Fb hCG |
|
< 50 |
1.56 |
1.27 |
|
52 |
1.29 |
1.22 |
|
57 |
1.05 |
>1.09 |
|
62 |
1.07 |
1.0 |
|
67 |
1.05 |
1.09 |
|
72 |
0.74 |
0.92 |
|
77 |
0.80 |
0.82 |
|
82 |
0.85 |
0.92 |
|
87 |
0.70 |
0.83 |
|
90+ |
0.46 |
0.6 |
- Kouření
Median MoM PAPP-A u kuřaček je významně snížen (0,81). Program neprovádí korekci hodnot PAPP-A u žen kuřaček automaticky.
Ultrazvukové markery aneuploidií ve II. trimestru [1,11,17,18,33]
Při nálezu závažné morfologické vady ve II. trimestru je ve většině případů indikováno chromozomální vyšetření plodu s rizikem pozitivního nálezu 10-80%.. S nejčastějšími aneuploidiemi jsou asociovány určité vady (tab. 14).
Tabulka 14: Závažné morfologické vady asociované s nejčastějšími aneuploidiemi.
|
Trisomie 21 |
Trisomie 18 |
Trisomie 13 |
|
Srdeční vady |
Srdeční vady |
Srdeční vady |
|
Atresie GIT |
Omphalokela + brániční hernie |
Omphalokela |
|
Hypoplasie nosní kosti |
Ventrikulomegalie/ VVV CNS |
Ventrikulomegalie/ holoprosencephalie |
|
Ventrikulomegalie |
VVV ledvin |
VVV ledvin |
|
VVV ledvin |
Překřížení prstů |
Obličejové VVV |
|
|
Deformity končetin |
Polydaktylie |
|
|
Obličejové VVV |
|
U indikované skupiny těhotných ( např. v hraničním věku nebo v hraničním riziku aneuploidie) je indikováno pátrání po tzv. „minor“ známkách aneuploidií, což jsou biometrické polymorfismy vyskytující se i v populaci normálních plodů. Nejdůležitějšími ultrazvukovými minor markery T21 ve II. trimestru jsou: zvýšená nuchální řasa (NSF), zkrácení dlouhých kostí – humeru (HL) a femuru (FL) a zvýšená echogenita GIT. Nález hraniční pyelektazie nebo intrakardiálního fokusu je méně významný.
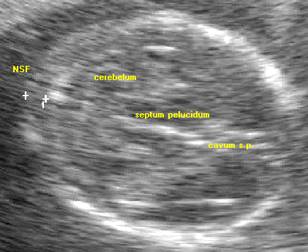
NSF má oproti nuchální translucenci (NT) v I. trimestru odlišný anatomický substrát a odpovídá volné kůži nad částečně osifikovanou týlní kostí. Podle některých zpráv není mezi NT a NSF korelace. NSF se měří v axiální rovině zahrnující thalamus, cavum septi pellucidi, cerebellum a nejníže položenou část týlní kosti. Kalipery se umístí na zevní okraj kostí týlní a zevní ohraj kůže. (viz obrázek).
Hodnota NSF stoupá s gestačním věkem: [34]. Hraniční hodnoty NSF jsou 5 mm do 18 gestačního týdne a 6 mm v gestačním věku nad 18 týdnů.
Adjustace rizika T21 minor markery ve II. trimestru. [17,18, 33]
Adjustace rizika T21 minor UZ markery by mohla být vhodná v případech hraničního rizika v I .-II. trimestru nebo při nerozhodnosti, zda podstoupit či nepodstoupit invazivní prenatální vyšetření.
Při předpokladu, že minor markery T21 jsou nezávislé a jejich prevalenci 0,6 -5 % u normálních plodů, je možno odhadnout věrohodnostní poměr (LR) v případě nálezu minor markeru.
Tabulka 15: Věrohodnostní koeficienty (LR) minor UZ markerů ve II. Trimestru [33].
|
Minor marker |
Prevalence u normálních plodů (%) |
Prevalence u plodů s trisomií 21 (%) |
LR u izolovaného nálezu |
|
Zvýšené nuchální ztluštění (NSF ) |
0,6 |
33.5 |
9.8 |
|
Krátký humerus (HL) |
1.5 |
33.4 |
4.1 |
|
Krátký femur (FL) |
5.2 |
41.4 |
1.6 |
|
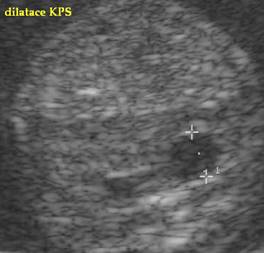
Pyelektasie >6mm |
2.6 |
17.6 |
1 |
|
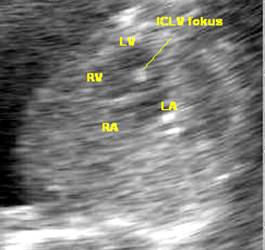
Intrakardiální echogennní focus (ICLV) |
4.4 |
28.2 |
1.1 |
|
Hyperechogenní GIT |
0.6 |
13.3 |
3 |
Nepřítomnost minor markerů snižuje riziko trisomie přibližně 0,3-0,5 krát.
Ukázky minormarkerů:
Ultrazvuková biometrie v II. trimestru [3,4,5,14,15]
Pro biparietální diametr (BPD), obvod hlavy (HC), cephalický index (CI), průměrný abdominální diameter (AD) , abdominální circumferenci (AC) , délku femuru (FL) a délku humeru (HL) měřené mezi 12-40 týdnem jsou použity dva recentní zdroje dat:
- ”Anglické” normy publikované Chitty at al. Roku 1994 a 2002, [3,4,5,35].
Tento soubor dat je používán v případě, že BPD je měřen mezi zevním a vnitřním okrajem kalvy. Při tomto způsobu měření není možno měřit CI.
- ”Švýcarské” normy publikované by Kurmaviciem et al 1999 [14,15]. Tyto normy jsou nastaveny pokud je BPD měřen mezi zevními okraji kalvy.
Tabulka 16: Srovnání norem BPD ”Anglického” a ”Švýcarského” nastavení s normami publikovanými Kulovaným et al. (50 centily a SD v mm)
|
Gest. |
Kulovaný |
Chitty |
SD |
|
Chitty |
SD |
Kurmavicius |
SD |
|
14 |
27 |
25.6 |
2.2 |
|
27.3 |
2.3 |
28.7 |
2.56 |
|
16 |
33 |
32.8 |
2.3 |
|
34.8 |
2.5 |
36.2 |
2.69 |
|
20 |
47 |
46.5 |
2.6 |
|
48.8 |
2.7 |
50.4 |
2.95 |
|
24 |
61 |
59.2 |
2.9 |
|
61.8 |
2.9 |
63.4 |
3.22 |
|
28 |
73 |
70.5 |
3.2 |
|
73.4 |
3.2 |
74.9 |
3.48 |
Tabulka 10 : Srovnání norem FL ”Anglického” a ”Švýcarského” nastavení s normami publikovanými Kulovaným et al. (50centil a SD v mm)
|
Gest. |
Kulovany |
Chitty |
SD |
Kurmavicius |
SD |
|
14 |
13 |
14,1 |
1.9 |
13,6 |
2.03 |
|
16 |
19 |
20,3 |
2.0 |
20 |
2.25 |
|
20 |
31 |
32,1 |
2.2 |
31,9 |
2.57 |
|
24 |
42 |
42,9 |
2.5 |
42,6 |
2.78 |
|
28 |
53 |
52,7 |
2.7 |
52,3 |
2.93 |
Z-skóre [14,15]
Z-skóre vyjadřuje relativní velikost rozdílu mezi naměřeným a očekávaným parametrem dle referenčního gestačního stáří . (Podíl rozdílu a směrodatné odchylky). Významná hodnota Z-skóre, eventuální rozdíl Z-skóre dvou parametrů je buď více než 1,65 (naměřená hodnota větší než 95 percentil) nebo méně než -1,65 (naměřená hodnota menší než 5 percentil).
Rozdíly z-skóre jednotlivých ultrazvukových parametrů lze použít k hodnocení symetrie plodu ( např. relativní zkrácení dlouhých kostí), rozdíly z-skóre určitých parametrů mezi měřeními lze použít ke zhodnocení dynamiky růstu plodu.
Screening T18 [28,29]
Edwarsův syndrom (trisomie chromozomu č. 18 - T18) se vyskytuje s porodní prevalencí kolem 1/7000. Riziko T18 stoupá s věkem matky a mezi 12 týdnem a termínem se potratí asi 85 % plodů.
Tabulka 11: Riziko T18 ve 12. gestačním týdnu a v termínu dle věku matky: ..
|
Věk v termínu |
Specifické riziko T18 |
Specifické riziko T18 |
|
20 |
1/2484 |
1/18013 |
|
25 |
1/2200 |
1/15951 |
|
30 |
1/1456 |
1/10554 |
|
35 |
1/580 |
1/4202 |
|
40 |
1/157 |
1/1139 |
Klinické známky T18:
- IUGR s neonatální hypotonií přecházející v hypertonus.
- Prominující occiput s úzkou bifrontální vzdáleností a nízko posazenými boltci.
- Krátké sternum, srdeční vady: nejčastěji defekt komorového septa.
- Překřížení prstů HK : V. prst překřižuje IV. a II. prst překřižuje III.
- Úzká pánev. Konvexní chodidlo s prominujíci patou (fenomen houpacího koně).
- První rok věku přežívá 10% postižených.
U těhotenství s plodem postiženým T18 je zvýšená NT a snížené hodnoty biochemických markerů.
Tabulka 12. Parametry skríningových markerů T18 v I. trimestru:
|
Marker |
Průměrná hodnota u T18 (MoM) |
|
NT |
3,2 |
|
Fß hCG |
0,28 |
|
PAPP-A |
0.17 |
Screening T18 je nahrazen screeningem obou častých aneuploidií T13/181.
Odpovědní autoři
- MUDr. David Stejskal
- MUDr Miroslav Břešťák , GENNET CZ, Praha
Literatura
- Bahado-Singh, R.O. et al.: Combined ultrasound biometry, serum markers and age for Down syndrome risk estimation. Ultrasound Obstet. Gynecol.,2000,15:199-204.
- Bahado-Singh, R., Oz, U., Shahabi, S., Omrani,A., Mahoney, M., Cole.L.: Urine hyperglycosylated hCG plus ultrasound biometry for detection of Down syndrome in the second trimester in a high risk population. Obstet. Gynecol,2000,95(6):889-894.
- Chitty, L.S., Altman, D.G., Henderson. A., Campbell, S.: Charts of fetal size: 2.Head measurements. BJOG,1994,101:35-43.
- Chitty, L.S., Altman, D.G., Henderson. A., Campbell, S.: Charts of fetal size: 3.Abdominal measurements. BJOG,1994,101:125-131.
- Chitty, L.S., Altman, D.G., Henderson. A., Campbell, S.: Charts of fetal size: 4. Femur lenght. BJOG,1994,101:132-135.
- Crossley,J.A., Aitken, D.A.: Letter to editor: Deriving risk of Down´s syndrome from nuchal translucency measurements. Ultrasound Obstet. Gynecol.,1999,14:438
- Cuckle H.S, Wald N.J, Thompson S.G.: Estimating a womans risk of having a pregnancy with Downs syndrome using her age and serum alpha-fetoprotein level. Br J Obstet Gynaecol 1987,94:387-402.
- Cuckle, H.S.: Established markers in second trimester maternal serum. Early Hum. Devel., 1996,47(suppl):S27-S29.
- Cuckle , H.S., van Lith, J.M.M.: Appropriate Biochemical Parameters in First-trimester Screening for Down Syndrome. Prenat. Diagn.,1999,19:505-512.
- de Graaf, I.M., Cuckle, H.S., Pajkrt, E., Leschot, N.J., Bleker, O.P., van Lith, J.M.M.: Co-variables in first trimester maternal serum screening. Prenat. Diagn.,2000,20:186-189.
- Drugan, A. et al . Ultrasound Screening for Fetal Chromosome Anomalies. , Am.J.Med.Genet.,2000,90:98-107. Editorial. Down´s Screening News,1999,6 (1):29.
- Grudzinskas,J.G., Chard.T., Chapman,M. Cuckle,H. (eds): Screening for Down´s Syndrome. Cambridge University Press, Cambridge, 1994.
- Krantz. D.A., Hallahan, T.W., Orlandi, F., Buchanan, P., Larsen, J.W., Macri, J.N.: First-Trimester down syndrome screening using dried blood biochemistry and nuchal translucency. Obstet Gynecol.,2000, Aug 1;96(2):207-213.
- Kurmanavicius, J. et al. Fetal ultrasound biometry: 1. Head reference values. BJOG,1999,106:126-135.
- Kurmanavicius, J. et al. Fetal ultrasound biometry: 2. Abdomen nad femur length refecence values., BJOG,1999,106:136-143.
- Nicolaides , K.H., Snijders, R.J.M., Cuckle, H.S.: Correct estimation of parameters for ultrasound nuchal translucency screening. Prenat. Diagn., 1998, 18:511-523.
- Nyberg, D.A, Resta, R.G, Luthy, D.A, et al. Humerus and femur length shortening in the detection of Downs syndrome. Am J Obstet Gynecol 1993,168:534-539.
- Nyberg,D.A, Luthy,D.A, Resta,R.G, et al. Age-adjusted ultrasound risk assessment for fetal Down´s syndrome during the second trimester: description of the method and analysis of 142 cases. Ultrasound Obstet. Gynecol.,1998,12:8-14.
- Snijders,R.J.M., Noble,P., Sebire,N., Souka,A., Nicolaides,KH.: UK multicentre project on assessment of risk of trisomy 21 by maternal age and fetal nuchal translucency thickness at 10-14 weeks of gestation. Lancet,1998,351:343-346.
- Spencer, K.: Screening for trisomy 21 in twin pregnancies in the first trimester using free b -hCG and PAPP-A, combined with fetal nuchal translucency thickness. Prenat. Diagn. ,2000,20:91-95.
- Wald, N.J., Cuckle, H.S., Densem, J.W., Nanchahal, K., Royston, P., Haddow, J.E., Palomaki, G.E., Canick, J.: Maternal serum screening for Downs syndrome in early pregnancy. Br. Med .J., 1988, 297,s.883-887.
- Wald, N.J., Densem, J.W., George, L. et al.: Inhibin-A in Down´s syndrome pregnancies: revised estimate of standard deviation. Prenat. Diagn.,1997,17:285-280.
- Wald, N.J., Hackshaw, A. K.: Combining ultrasound and biochemistry in first- trimester screening for Down´s syndrome. Prenat. Diagn., 1997,17:.821-829.
- Wald, N.J., Watt, H.C., Hackshaw, A.K.: Integrated screening for Down´s syndrome based on test performed during the first and second trimesters. N.Engl.J.Med.,1999,341:461-467.
- Hájek, Z., Kulovaný, E.,Macek,M.: Základy prenatální diagnostiky, Grada publishing, Praha, 2000.
- Šípek.A., Gregor, V., Horáček, J., Chudobová, M.: Downův syndrom v ČR v období 1961-1997. Čes. Gynek., 1999,3: 173-179.
- Robinson, H.P., Fleming,J.E: A critical evaluation of sonar “crown-rump length” measurement. Br.J.Obstet.Gynaecol.,1975,9:702-710.
- The 10-14 Week Scan. Theoretical Course Manual. The Fetal Medicine Foundation, 1997.
- Tul.,N., Spencer.K., Noble,P., Chan, Ch., Nicolaides.K.: Screening for trisomy 18 by Fetal Nuchal Translucency and Maternal Serum free ß-hCG and PAPP-A at 10-14 Weeks of Gestation. Prenat Diagn., 1999,19:1035-1042.
- Snijders, RJ., Sebire, NJ., Nicolaides, KH.: Maternal age and gestational age-specific risk for chromosomal defects. Fetal Diagn Ther. 1995 Nov-Dec;10(6):356-67.
- Spencer, K., Nicolaides, KH.: A first trimester trisomy 13/trisomy 18 risk algorithm combining fetal nuchal translucency thickness, maternal serum free beta-hCG and PAPP-A. Prenat Diagn. 2002 Oct;22(10):877-9.
- Snijders, R.J.M., Sundberg, K., Holzgreve, W., Henry, G., Nicolaides, K.H. Maternal age- and gestation specific risk for trisomy 21. Ultrasound Obstet Gynecol, 1999,13:167-170 .
- Nicolaides, K.H.: Screening for chromosomal defects. Ultrasound Obstet Gynecol,2003,21:313-321
- Lee, P.R., Won.H.S., Chung,J.Y., Shin,H.J., Kim,A: The variable affecting nuchal skin-fold thickness in mid-trimester. Prenat Diagn. 2003 ;23(1):60-64.
- Chitty, L.S., Altman,D.G.: Charts of fetal size: limb bones. Br.J.Obstet.Gynaecol.,2002,109:919-929.
- Cicero,S., Curcio, P., Papageorghiou,A., Sonek, J., Nicolaides, K.H.: Absence of nasal bone in fetuses with trisomy 21 at 11-14 weeks of gestation :an observational study. Lancet,2001,358:1665-1667.
- Sonek, J.D., Nicolaides, K.: Prenatal ultrasonographic diagnosis of nasal bode abnormalities in three fetuses with Down syndrome. Am. J.Obstet.Gynecol.,2002,189:139-141.
- Cicero,S., Sonek, J.D.,McKenna, D.D., Crooms,C.S., Johnson,L., Nicolaides, K.H.: Nasal bone hypoplasia in trisomy 21 at 12-22 weeks´ gestation. Ultrasound Obstet Gynecol,2003,21:15-18.
- Sonek,J.D., McKenna,D., Webb,D., Croom, C., Nicolaides, K.: Nasal bone length throuhghout gestation: normal ranges based on 3537 fetal ultrasound measurements. Ultrasound Obstet Gynecol,2003,21:152-155.
- Cicero,S., Rembouskos,H., Vandecruys, M., Hogg,M., Nicolaides, K.H.: Likelihood ratio for trisomy 21 in fetuses with absent nasal bone at the 11-14 –week scan. Ultrasound Obstet Gynecol,2004,23:218-223.
- Borrell, A., Martinez, JM., Seres, A., Borobio, V., Cararach, V., Fortuny, A. :Ductus venosus assessment at the time of nuchal translucency measurement in the detection of fetal aneuploidy. Prenat Diagn. 2003,23(11):921-6.
- Cicero, S., Curcio, P., Rembouskos, G., Sonek, J., Nicolaides, KH.: Maxillary length at 11-14 weeks of gestation in fetuses with trisomy 21.Ultrasound Obstet Gynecol. 2004 Jul;24(1):19-22.
SmartOSG - průvodce porodníka screeningem
SmartMEDIX® OSG (Obstetrician´s Screening Guide) je interpretační a organizační program pro prenatální screening Downova syndromu a dalších patologických stavů v těhotenství.
Algoritmy použité v programu vycházejí z validních publikovaných údajů o použití ultrazvukových a sérových markerů při detekci Downova syndromu v prvním a druhém trimestru těhotenství. Garantem modulu je prim. MUDr. David Stejskal, společnost Gennet s.r.o. Praha.
Základní vlastnosti modulu
- Návrh optimálních termínů prenatálních screeningových vyšetření.
- Tisk žádanek pro následná biochemická vyšetření.
- Výpočet rizika postižení plodu Downovým syndromem (Trisomie 21) a Edwardsovým/Patauovým syndromem (Trisomie 13/18) z hodnot plazmatického těhotenského proteinu A (PAPP-A) a volné beta podjednotky choriového gonadotropinu (Fß hCG) v krvi matky a ultrazvukového projasnění šíje plodu (nuchální translucence - NT) v 10. - 13. týdnu (Kombinovaný test).
- Tisk zpráv o výsledcích screeningu v I. a II. trimestru v různých jazykových verzích
- Hodnocení základních biometrických ultrazvukových parametrů ve II.trimestru.
- Export dat pro provedení auditu ve formátu Nadace Fetální Medicíny
Výstupy programu OSG nejsou určeny ke stanovení diagnózy, ale k orientačnímu (screeningovému) posouzení stavu plodu a průběhu těhotenství. Výstupy je nutné posuzovat společně s anamnestickými údaji, výsledky dalších zobrazovacích a laboratorních vyšetření a následný další postup je na úvaze ošetřujícího lékaře.